基于细胞基因特征“追踪”肿瘤免疫逃逸
本文转自原创挑食的喵闲谈 Immunology2022-04-27 08:06
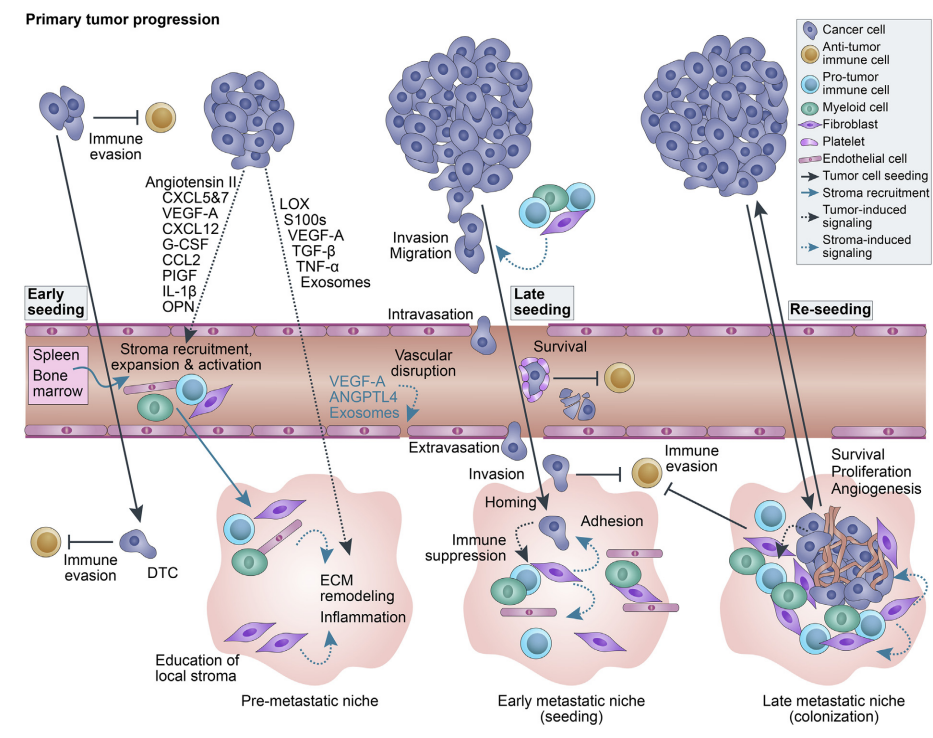
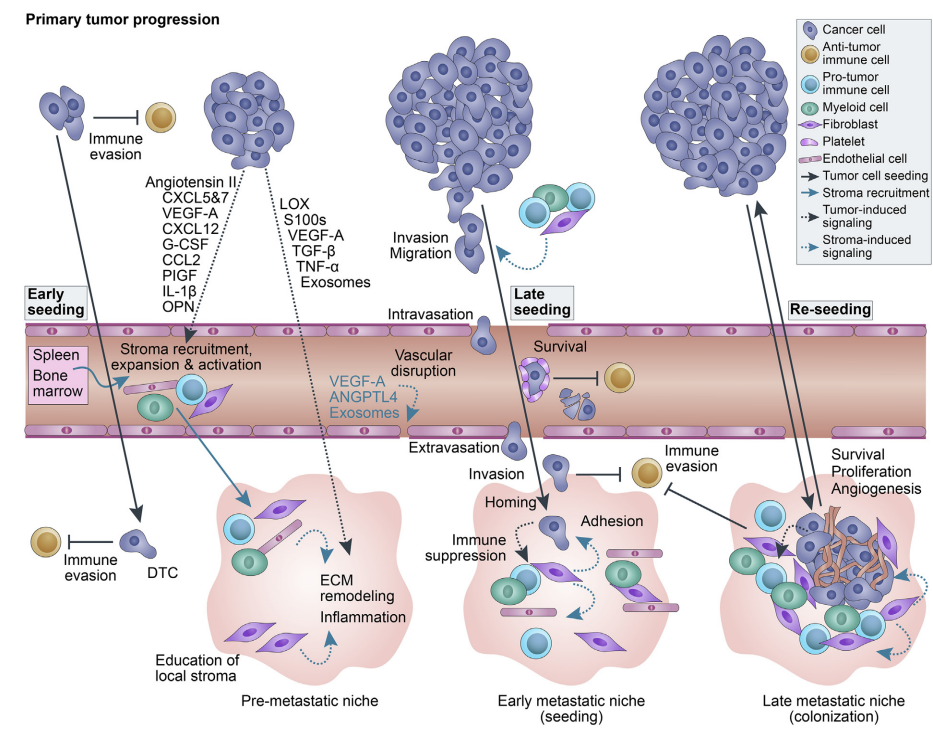
免疫逃避(immune evasion)是癌症发生和转移的关键。追踪免疫逃逸的动态过程,有助于阐述其在治疗干预中的潜在应用价值。
免疫逃逸“追踪”研究
最近新加坡国立大学Duke转化免疫学研究所、南洋理工大学、新加坡科技研究局(A*STAR)分子细胞研究所等单位的科学家做了这项“追踪”工作。他们选择了肝细胞癌(Hepatocellular carcinoma ,HCC),全球第四大常见癌症。
肿瘤分期及免疫微环境动态变化
免疫微环境在肿瘤的发展中起着至关重要的作用,特别是HCC,长期的肝脏炎症或慢性肝炎感染往往先于癌变。肿瘤微环境(TME)的免疫细胞组成,有助于预测疾病的预后。
本研究监测免疫细胞所用的标志物
- Treg:CD4+CD152+FoxP3+TIGIT
- Naive T:CD4+CD27+CD45RO-
- 增殖T细胞:CD3+Ki67+
- 激活CD8+T:CD8+GB+PD-1-
- 组织驻留记忆T细胞:CD103+CD45RO+PD-1+
- 记忆CD4+T细胞:PD1+ CD45RO+CD4+
- NKT:GB+CD56+CD8+
- NK细胞:GB+CD56+
- 髓系细胞:HLA-DR+CD14+
- B细胞:HLA-DR+CD19+
肿瘤的起始和进展需要逃离免疫系统,这代表了癌症和宿主之间正在进行的军备竞赛。
样本
免疫逃避在肿瘤早期和晚期阶段都存在,具有不同的特征和机制。基于TNM(肿瘤大小、淋巴结参与和转移)分期,选择I-III期HCC患者,样本包括肿瘤(Tumor,T)、邻近的非肿瘤组织(Non-tumor,N)和血液(peripheral blood,P),揭示早期和持续的免疫逃逸。
1. 第一波免疫逃逸发生在肿瘤发生的早期阶段,逃离免疫监视,获得生长优势,原发病灶迅速增大。
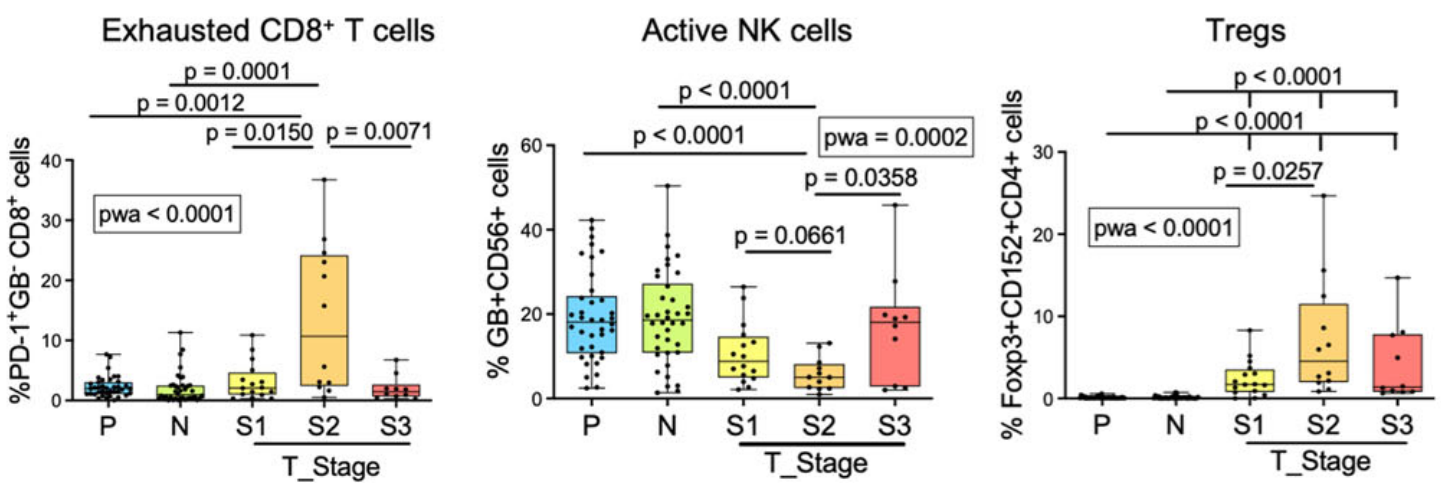
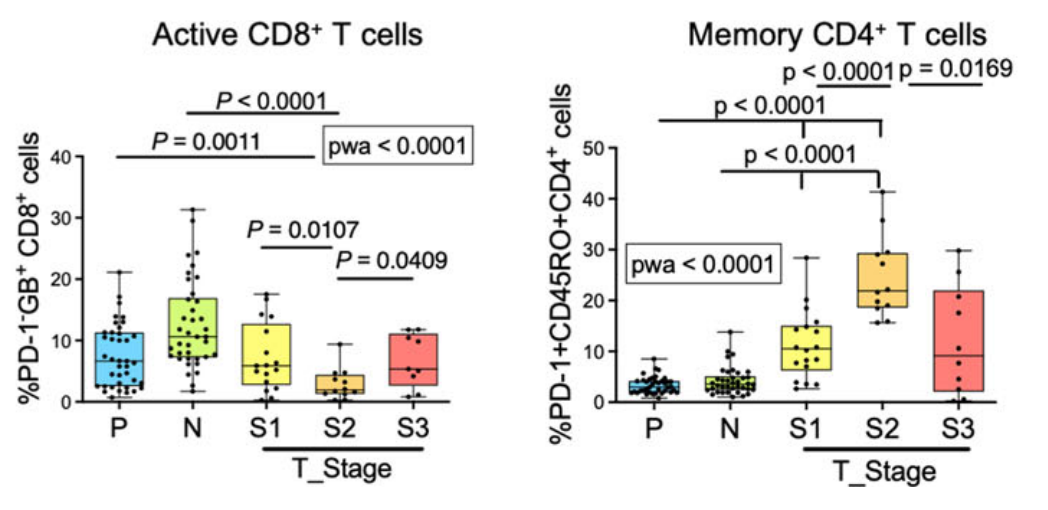
2. 本次研究者发现:第二波免疫逃逸和同时发生的肿瘤进展在II期HCC达到高峰。特点1)细胞特征
- 耗竭CD8+T细胞和Treg的细胞数量达到“顶峰”
- NK细胞数量、激活的CD8+T细胞降到“谷底”
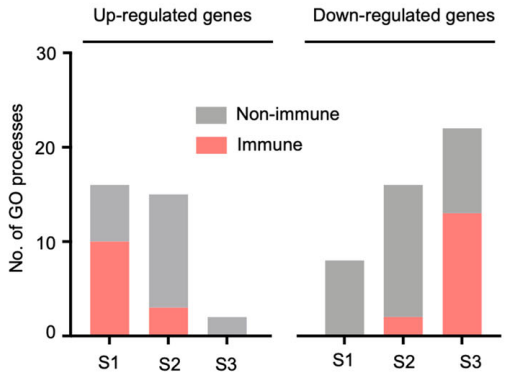
2)基因特征RNA-seq的结果
- S2期虽然整体基因上调没有变化,但是免疫相关基因上调比例显著降低,免疫相关基因下调开始增加,尤其是趋化相关基因。
- S3期,基因大多属于下调的状态,其中免疫相关基因下调尤其显著(TCR信号;IFN-γ、TNF通路;T细胞趋化等)。
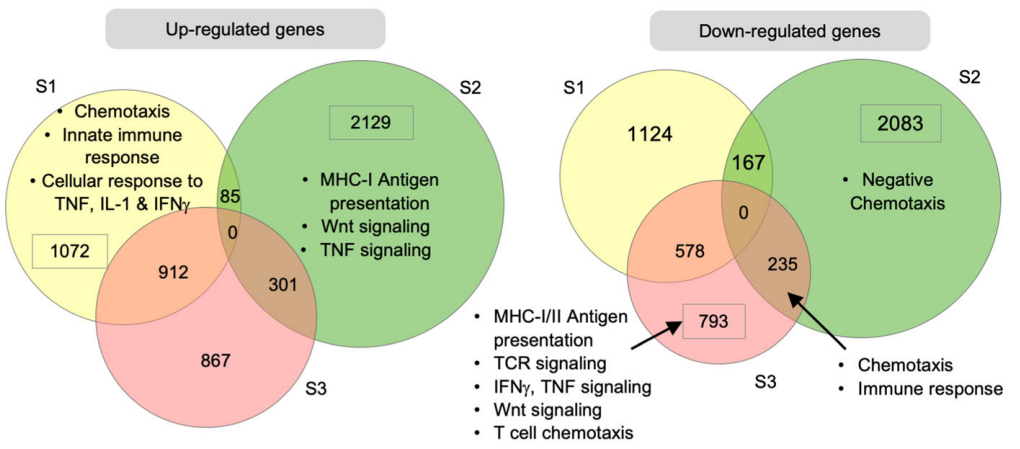
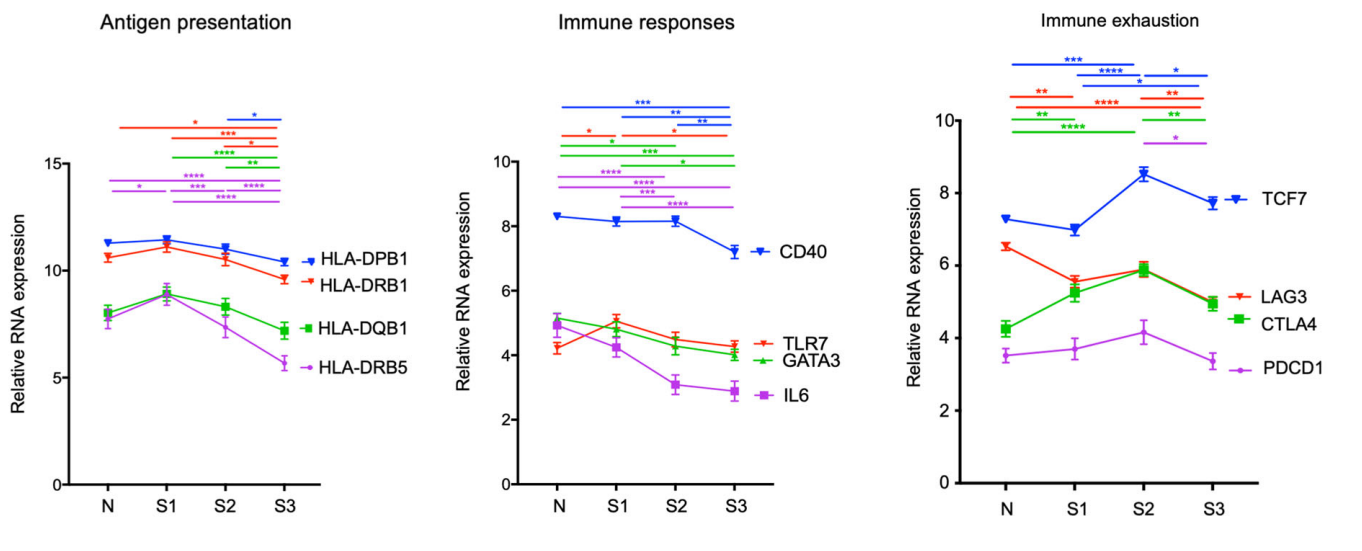
3)关键免疫分子特征
- 抗原提呈分子下调:HLA-DQB1,HLA-DQB5
- 免疫应答相关分子下调:CD40,TLR7,GATA3,IL-6
- 免疫耗竭分子上调:LAG3、CTLA-4、PDCD1
简评:
肿瘤发生、进展、转归是肿瘤与免疫系统的军备竞赛,此消彼长。之前免疫编辑理论,将肿瘤进展前的免疫归为三个阶段:清除(elimination)、平衡(equilibrium)、逃逸(escape)。第一次逃逸以后,肿瘤开始快速扩增。
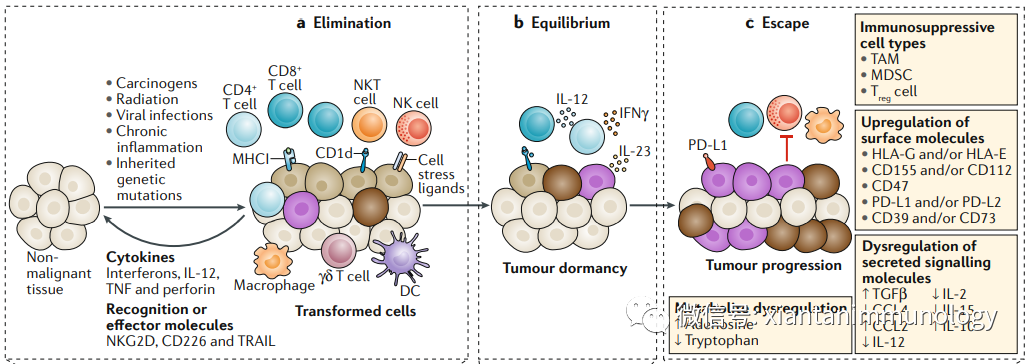
第二波免疫逃逸发生在肿瘤进展的中期,效应免疫细胞开始出现耗竭表型,并且抗原提呈分子和应答的共刺激分子等下调,趋化因子表达下调;免疫抑制细胞开始增加等。为肿瘤转移做好铺垫。因而此期免疫检查点阻断治疗很关键,对于减少转移的发生,获得良好的临床转归显得很关键。
参考文献
- M. Alečković, et al. Metastasis as a systemic disease: molecular insights and clinical implications.BBA - Reviews on Cancer 1872 (2019) 89–102
- Jake S O'Donnell et al, Cancer immunoediting and resistance to T cell-based immunotherapy, Nat Rev Clin Oncol . 2019 Mar;16(3):151-167.
- Phuong H. D. Nguyen et al, Trajectory of immune evasion and cancer progression in hepatocellular carcinoma.NATURE COMMUNICATIONS ,(2022) 13:1441