抗体糖基化与工程改造
以下文章来源于闲谈 Immunology,作者挑食的喵
1 抗体糖基化
IgG活性取决于IgG亚型和Fc段糖基化。
- 四个人类IgG:IgG1-4,IgG1和IgG3与I型FcγRs具有高的亲和力。
- Fc段CH2结构域的Asp297 N-连接寡糖复合物,对于Fc结构极为重要。糖基化调节Fc构象的稳定程度,进而影响Fc和1型及2型FcγR的结合。
核心7糖结构:四个N-乙酰葡糖胺和三个甘露糖残基。
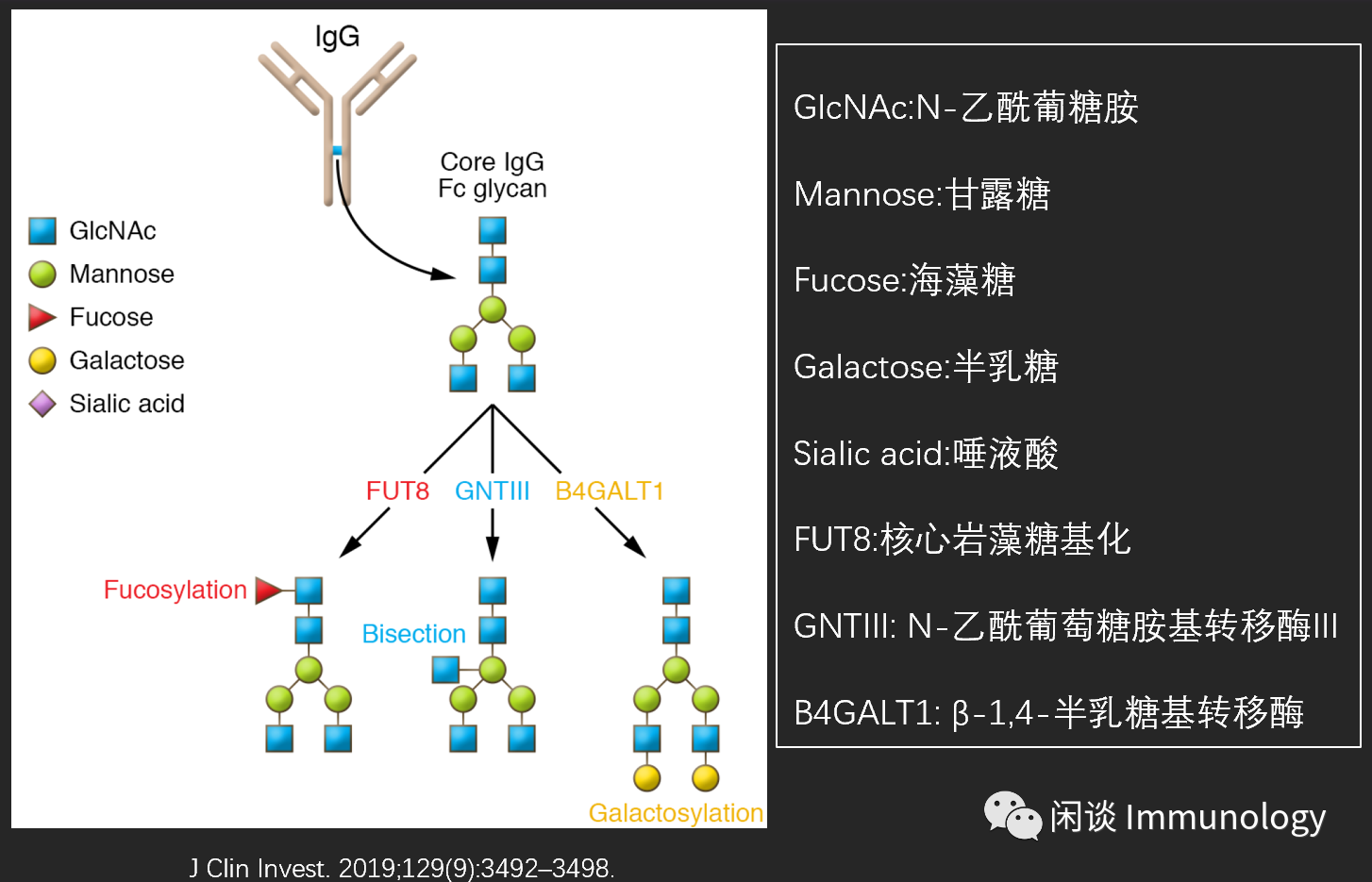
核心Fc糖基化改造
- 核心岩藻糖基化;
- 双切乙酰葡萄糖胺化;
- 单臂或两臂的半乳糖化;
- 半乳糖的存在下添加末端唾液酸。
核心岩藻糖存在,末端唾液酸修饰会破坏Fc稳定性,出现与2型FcγR结合构象。
缺乏核心岩藻糖,增强Fc段和1型FcγR结合(此时不考虑唾液酸化的位置)。
现在研究比较清楚的是IgG1和FcR的结合,IgG2-4,还知之甚少。
N-糖基化位点与抗体可开发性评估除了在Fc区中保守的N-糖基化位点之外,mAb在可变域中具有N-糖基化的共有序列(NXS/T,X不能为P)。可变结构域糖基化对抗原结合有影响,但对体内半衰期没有影响。Fab糖基化的末端半乳糖的较高水平,增加了通过α1,3-半乳糖和唾液酸化进一步半乳糖基化的可能性。与Fab相关的低聚糖加上α1,3-半乳糖(Gal)已显示出免疫原性。唾液酸化也可以增加N-羟乙酰神经氨酸(NGNA)的免疫原性部分。α-1,3Gal和NGNA的添加高度依赖于细胞系,应使用预期的稳定细胞系评估其水平。
2 FcγR分型、分布、信号通路
根据和特定糖修饰的Fc段结合能力差异,将FcγR分为1型和2型。1型FcγR(FcγRI、FcγRIIa、FcγRIIb、FcγRIIc、FcγRIIIa、FcγRIIIb)为免疫球蛋白超家族,与唾液酸化Fc段IgG结合弱。抗体通过Fc段结合FcγR,是抗体(抗体药物)发挥其抗感染及抗肿瘤功能所必需的。
2型FcγR(DC-SIGN/CD209, CD23/FcεRII),他们都是c型凝集素受体,在免疫复合物中结合唾液酸化的Fc段。DC-SIGN/CD209介导抗炎症信号,CD23介导生发中心B细胞选择。
3 抗体Fc改造增强ADCC
IgG1和IgG3可以诱导强的ADCC效应,但是IgG1比IgG3有更长的半衰期和更稳定的结构,所以ADCC效应抗体通常选择IgG1亚型。
要发挥ADCC效应,抗体需要和Fc受体(FcγR)结合。抗体通常通过铰链区及CH2区域和FcγR结合。CH2结构域的Asn-N297链接糖基化修饰,及修饰的糖型成分(如乙酰葡糖胺,甘露糖,岩藻糖和唾液酸等)决定CH2结构的稳定性及结合特性。因而ADCC效应抗体,Fc段糖修饰是主要的工程工艺。
工艺1:Fc糖基化改造IgG和FcγR的结合一般是低亲和力的,为了增强ADCC的功能,需要增加二者结合的亲和力。从FcγR在免疫细胞分布来看,NK细胞作为ADCC的主要效应细胞,主要表达FcγRIIIa。
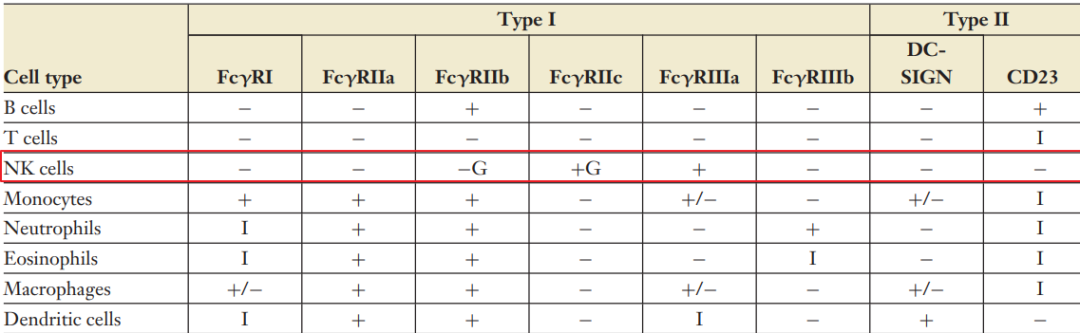
增强ADCC糖基化工程策略是增加和FcγRIIIa的结合,方法是去除核心的岩藻糖,增加IgG1 Fc与 FcγRIIIa Asn162结合。
当然去除Fucose也有一些问题,比如减少了FcγRIIIa可结合的IgG Fc构象多样性,抑制了糖和糖的直接结合。但是去除核心岩藻糖是增强ADCC普遍使用的策略。小范围内,半乳糖苷化可以调节Fc和FcγRIIIa的结合,但是在没有去除岩藻糖的情况下,结果变异比较大,从完全没有增强效应到有很好的增强效应,原因是半乳糖与FcγRIIIa不同N糖结合。Fc段的唾液酸化对ADCC的影响是最小的。
方法2:定点突变高分辨率结构分析,可以解析IgG Fc和FcγR结合的氨基酸位点,可以有针对性的进行点突变,现在发现的主要位点有,下铰链的Leu234–Ser239和CH2结构域的Asp265–Glu269, Asn297–Thr299。所以在这些区域,或者临近区域的突变,提高亲和力。目前S298A/E333A/K334A 和S239D/I332E已经被证实可以增强ADCC。P247I/A339Q被用于第三代CD20抗体ocaratuzumab,被证实有很好的效果。
结构分析显示,Fc和FcγR结合是不对称的,Fc段突变造成的不对称性,可以最大程度增加和FcγR的亲和力。Fc突变形成的异二聚体,可以提高CH2结构的稳定性,以及和FcγR的亲和力。
工艺3:Fc段多聚体和糖型改造,点突变相比,增加IgG1的Fc段数量(一个抗体带多个Fc段)显得更加的直接。一个IgG1带有多个Fc段,结合多个FcγRIIIa,增强ADCC作用。
简评:糖基化是抗体药物关键质量属性,需要系统表征。
参考文献
- Shields RL, et al. High resolution mapping of the binding site on human IgG1 for Fc gamma RI, Fc gamma RII, Fc gamma RIII, and FcRn and designof IgG1 variants with improved binding to the Fc gamma R. J Biol Chem. 2001;276(9):6591–6604.
- Taia T. Wang and Jeffrey V. Ravetch,Functional diversification of IgGs through Fc glycosylation,J Clin Invest. 2019;129(9):3492–3498.
- Ahmed AA, et al. Structural characterization of anti-inflammatory immunoglobulin G Fc proteins. J Mol Biol. 2014;426(18):3166–3179.
- Wang TT, et al. Anti-HA glycoforms drive B cell affinity selection and determine influenza vaccine efficacy. Cell. 2015;162(1):160–169.
- Anthony RM, Nimmerjahn F, Ashline DJ, Reinhold VN, Paulson JC, Ravetch JV. Recapitulation of IVIG anti-inflammatory activity with a recombinant IgG Fc. Science. 2008;320(5874):373–376.
- Stylianos Bournazos, et al, Signaling by Antibodies: Recent Progress,Annu. Rev. Immunol. 2017. 35:285–311
- Stylianos Bournazos,Jeffrey V. Ravetch,Fc receptor pathways during active and passive immunization.Immunological Reviews 2015,Vol. 268: 88–1031