CAR-T治疗如何实现旁观杀伤效应?

life cycle of a CAR-T cell传统CAR-T在实体瘤中很难发挥作用。肿瘤微环境是趋向于免疫逃逸的:其中存在像Treg,MDSC这样抑制T细胞抗肿瘤免疫反应的细胞;肿瘤表面表达促进T细胞耗竭的免疫检查点分子,像PD-L1;实体瘤具有异质性,肿瘤细胞表面呈递的抗原复杂多样且呈递水平参差不齐。这些都使针对实体瘤开发的CAR-T疗法的免疫浸润成为难题。
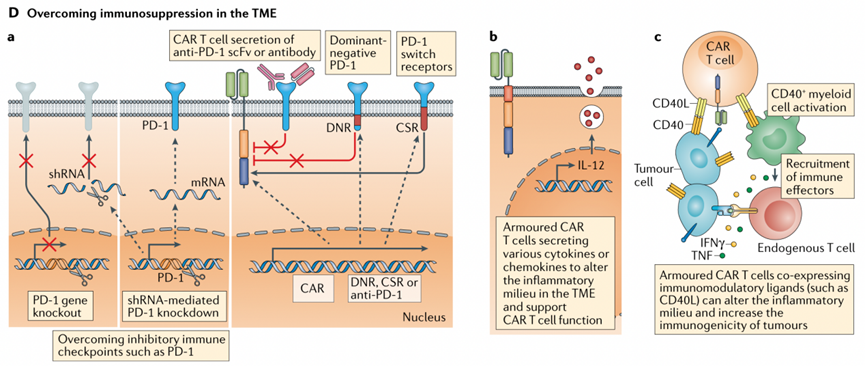
在以往研究中克服免疫抑制性肿瘤微环境的思路有:a. 限制CAR-T细胞PD-1的活性;b. 赋予CAR-T自分泌促炎因子的能力,抵消免疫抑制性肿瘤微环境 c. 使CAR-T表达免疫调节性分子,如添加的促炎分子CD40L通过与CD40的作用,不但能产生共刺激效应增强CAR-T细胞功能,而且能激活专职抗原呈递细胞,呈递肿瘤抗原,增加肿瘤细胞免疫原性,进而使肿瘤细胞被内源性T细胞识别。

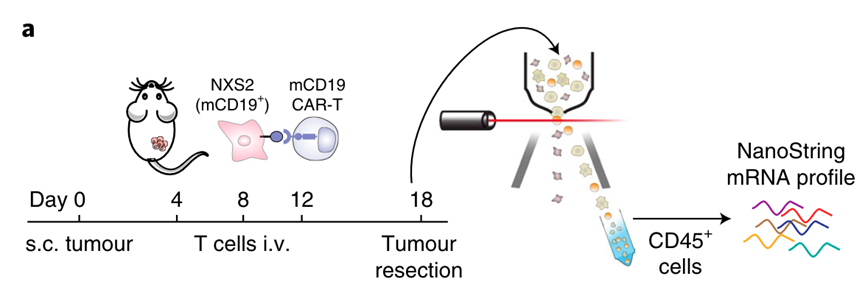
本文作者将幽门螺旋杆菌来源的NAP(neutrophil-activating protein,中性粒细胞激活蛋白)编码序列和CAR序列通过逆转录病毒和慢病毒整合到小鼠的T细胞和健康人来源的PBMC中,构建并证明CAR(NAP)-T能激活内源性抗肿瘤免疫反应。CAR-T分泌的NAP能招募天然免疫细胞的免疫激活因子(immune activator),并激活树突细胞,增强内源性CD8+T(CAR-target-independent bystander CD8+ T-cell)对肿瘤的杀伤。

作者对皮下移植了神经母细胞瘤的小鼠做针对CD19的过继性转移治疗,将肿瘤做流式分析。发现与未转入NAP的CAR-T相比,CAR(NAP)-T治疗后的肿瘤中有显著的巨噬细胞,中性粒细胞,细胞毒性NK细胞,抗原呈递性DC的浸润。
通过肿瘤裂解液细胞因子组成分析发现,CAR(NAP)-T实验组相对于CAR-T组富集了Th1相关细胞因子和促炎因子。
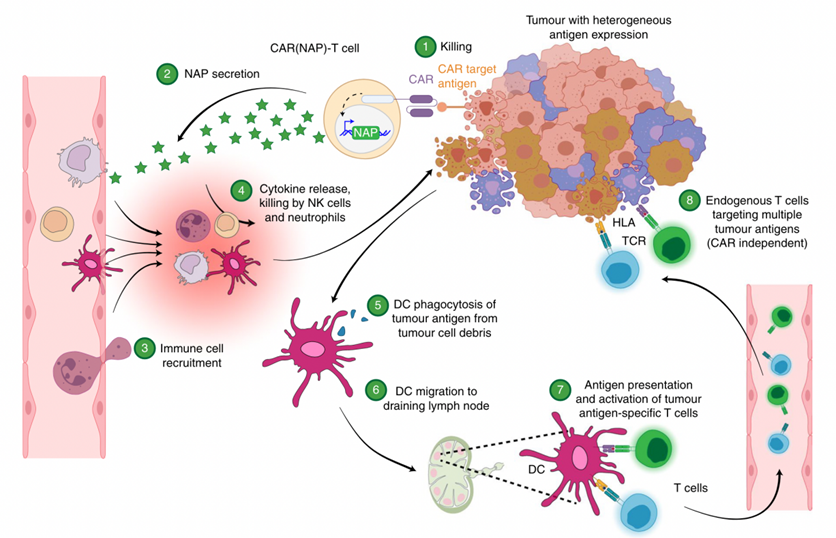
最后来一张图展示CAR(NAP)-T可能的效应机制:
(1)携带着NAP的CAR-T细胞来到提呈靶抗原的肿瘤细胞,CAR-T被激活并分泌穿孔素、颗粒酶实现对靶细胞杀伤。
(2)激活的CAR-T在诱导型NFat启动子(inducible nuclear factor of activated T-cells (NFAT) promoter)的介导下开始转录、翻译并分泌NAP。
(3)NAP作为细菌来源的抗原引发天然免疫反应。(4)招募中性粒和NK细胞,激活其对肿瘤细胞的非特异性直接杀伤。NAP也能招募单核和DC细胞,激活并使其分泌促炎细胞因子,中和宿主免疫抑制性的“冷”肿瘤微环境,增强CAR-T的功能。(5)未成熟的DC细胞吞噬肿瘤细胞的细胞碎片。(6)在此过程中DC成熟,迁移到引流淋巴结。(7)DC在淋巴结加工处理抗原,呈递抗原肽,即形成肿瘤相关抗原肽-HLA分子复合物、提成给体内未成熟的T细胞。带有与抗原肽相应受体的TCR识别该抗原肽并通过共刺激分子被激活,大量扩增该抗原肽特异性的T细胞。
(8)当这样的被激活的内源性T细胞通过血液循环浸润到肿瘤时,通过TCR与肿瘤抗原的识别可以特异性地消灭更多肿瘤细胞。
总结
总之,幽门螺旋杆菌来源的中性粒细胞激活蛋白——NAP具有激活内源免疫系统的功能,能招募内源性免疫细胞,联合只靶向单一抗原的传统CAR-T,实现1+1>2的效果,能更有效地应对抗原高异质性的实体瘤。
参考文献:1.Rafiq, S., Hackett, C.S. & Brentjens, R.J. Engineering strategies to overcome the current roadblocks in CAR T cell therapy. Nat Rev Clin Oncol 17, 147–167 (2020).2.Jin, C., Ma, J., Ramachandran, M. et al. CAR T cells expressing a bacterial virulence factor trigger potent bystander antitumour responses in solid cancers. Nat. Biomed. Eng 6, 830–841 (2022).
作者:宁帅同学编辑人:💧Transparent推文用于传递知识,如因版权等有疑问,请于本文刊发30日内联系医药速览。原创内容未经授权,禁止转载至其他平台。有问题可发邮件至yong_wang@pku.edu.cn获取更多信息。©2021 医药速览 保留所有权利来源:医药速览 2022-10-19