自噬与肿瘤的复杂关系
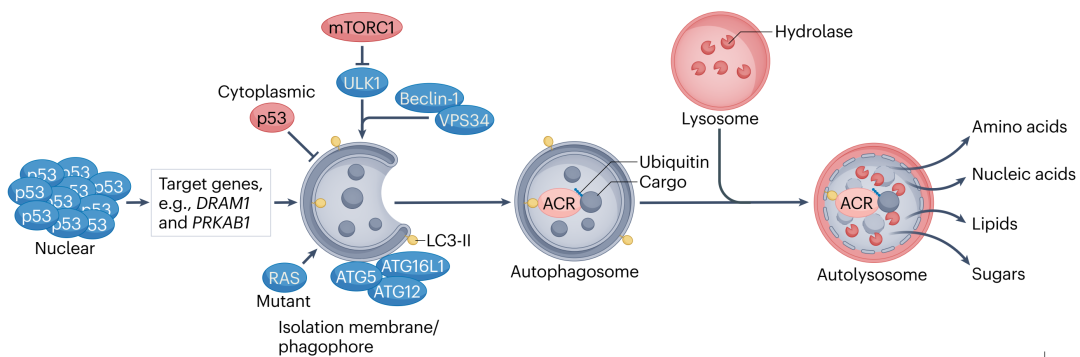
自噬是将各种细胞非必需货物运输到溶酶体并降解,用来维持蛋白质稳态和细胞器完整性的关键机制。
其中,巨自噬是细胞内最普遍的自噬方式,整个过程大致分为自噬体形成、融合溶酶体、降解包裹物、溶酶体再生这几个阶段,其中自噬体相关基因(ATG基因)、自噬货物受体(ACR)是自噬的关键成分。
自噬在在多种疾病过程中对机体具有重要的保护作用,在肿瘤发生、发展的过程中,自噬表现出双向的效应。
Nat Rev Mol Cell Biol. 2023 Mar 2:1–16.
自噬与肿瘤抑制性
自噬相关基因
现阶段对自噬的普遍认识是其对于肿瘤的发生发展有负向调节作用,在多种肿瘤发展的早期都可以观察到自噬相关基因受到抑制,如:
- BECN1(beclin-1),编码ATG6。
在乳腺癌中,常见BECN1等位基因缺失丢失;
BECN1基因全身半合子小鼠会有肝、肺、淋巴组织肿瘤形成。
- Atg7,编码ATG7。
在Atg7敲除小鼠模型中,由于肝脏的自噬功能丧失会导致组织破坏-再生循环,频繁出现的肝祖细胞推动肝肿瘤早期阶段的发生。
而其他部位中,与额外的遗传性疾病结合会导致各类肿瘤发生。
肿瘤抑制因子p53能够以多种方式调控自噬。生理状态下,胞质中p53抑制自噬,但发生DNA损伤等细胞应激时,p53表达水平升高,会刺激各种促进自噬的基因激活:
- DRAM1,编码受损自噬调节剂1(DRAM1);
- PRKAB1,编码AMPK。
随着肿瘤进展,部分自噬相关基因发生突变和失活,会使自噬对肿瘤的抑制作用减弱。如:
- 胃肠道和肝癌中,观察到ATG2B、ATG5、ATG9B、ATG12发生移码突变;
- 黑色素瘤中,ATG5、ATG7基因表达降低;
- 乳腺癌、胰腺癌中,BNIP3、BNIP3L基因缺失会促进这两类肿瘤发展。
自噬抑制肿瘤的相关机制
ROS会导致DNA损伤,有诱导肿瘤发生的风险。线粒体自噬、过氧化物酶自噬是消除ROS应激的关键机制。
以上两种自噬均属于选择性自噬,都基于ACR的选择性。
p62是一种ACR,肿瘤中的p62可以激活NF-κB和NRF2通路,这两个通路都具有促肿瘤效应。因此,通过自噬来维持适当水平的p62则是关键的肿瘤抑制作用。
自噬相关功能的促瘤作用
自噬与肿瘤代谢
而除了清除废物外,自噬的另一个作用就是回收营养物质。
在KRAS基因突变激活的小鼠模型中,肿瘤细胞增殖和生长增强,对能量的需求增加。特别是在肿瘤血管化不良区域、在外源性营养剥夺情况下,RAS基因会驱动自噬进行自我消化来减轻营养负担,从而维持并促进肿瘤发展。
虽然肿瘤细胞的代谢合成主要为糖酵解,但某些特定的合成代谢反应仍然需要线粒体功能,特别是谷氨酰胺代谢。
而通过线粒体自噬来维持线粒体完整,也是肿瘤发展的重要机制。
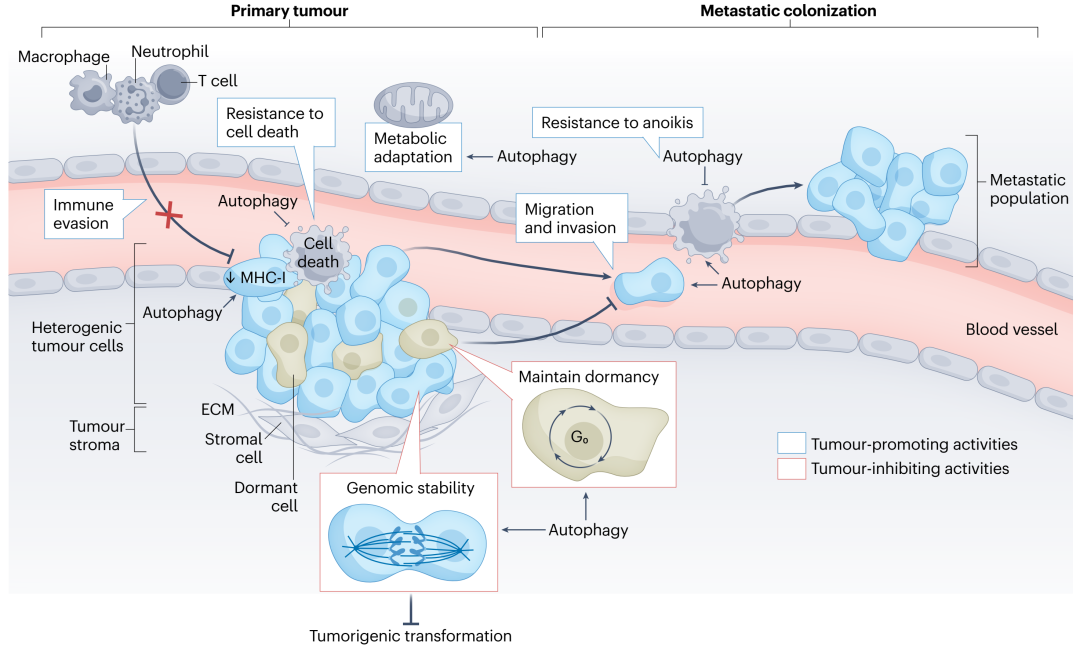
自噬与肿瘤转移
肿瘤细胞的转移涉及迁移、侵袭、上皮-间质转化(EMT)、抵抗凋亡、适应新的肿瘤微环境(TME)并存活,在这些过程中自噬均发挥在重要作用。
在自噬受损的情况下,会导致p62、NBR1这两类ACR积累。
p62:除了前面提及的高水平p62可以促进肿瘤发生,在自噬缺陷的乳腺癌小鼠中,p62积累可以防止糖酵解关键酶PFKFB3(果糖-2,6-二磷酸)降解,促进休眠的转移性肿瘤增殖和生长。
而且p62还可以抑制转录因子TWIST1的降解,而TWIST1是EMT的主要调节因子,促进肿瘤细胞EMT并增强转移性肿瘤的生长。
NBR1:积累的NBR1会促进更具侵袭性的肿瘤亚群发展。
Nat Rev Mol Cell Biol. 2023 Mar 2:1–16.
小结
自噬对肿瘤的不同作用可能取决于肿瘤生长阶段,目前普遍的认知是促进自噬可作为肿瘤治疗的方式,以此作为基础的蛋白质降解剂正在开发中。
参考文献
Debnath J et al. Autophagy and autophagy-related pathways in cancer. Nat Rev Mol Cell Biol. 2023 Mar 2:1–16.
来源:闲谈 Immunology 2023-03-14

